Objective�FTo explain the process of adopting and discontinuing drugs registered with a hospital or clinic by surveying the role and methods of hospital formulary development.
Methods�FA questionnaire was sent to 122 hospitals and clinics, among whose staff are members of the Japanese Society for Pharmacoepidemiology (JSPE). A total of 112 (91.8%) hospitals and clinics responded.
Results�F(1) A hospital formulary was developed in 72 (64.3%) of the 112 hospitals and clinics surveyed, while 32 (28.6%) developed a �gdrug list�h. (2) Developing a hospital formulary costs ten times more than developing a drug list. (3) Most of the information in the hospital formulary is derived from drug package inserts. (4) In 98 (87.5%) hospitals and clinics, the �ghospital drug committee�h decides which drugs to adopt or discontinue. (5) In 88 (78.6%) hospitals and clinics, the basic rule such as �gone new drug in, one drug out�h was used. (6) Discontinuing drugs was based on scarce use as reflected in hospital records. (7) The drug committees in 41 (41.8%) hospitals and clinics considered EBM in preparing materials for discussion, while those in 57 (58.2%) hospitals and clinics did not. However, there was not much difference between the materials used by the two groups.
Conclusion�FThe current status of the hospital formulary and new drugs adopting systems was only partly clarified. Drug information in electronic form should be further used to make information up to date. Standards for adopting and discontinuing drugs should be developed, and the methods of EBM and pharmacoeconomics should be used in the process. It is hoped that large-scale surveys on this topic will be conducted regularly.
Key words
hospital formulary, hospital drug list, hospital drug committee, new drugs adoption, EBM
�@�͂��߂�
�@��Ë@�ւł̈��i�̗̍p�͂ǂ̂悤�ɂȂ���Ă���̂��낤���D��ʂɂ͐��[�J�[������ꂽ�V��̏�����{�Ƃ��ĐR�c����C �̗p�̉ۂ����肷�邱�Ƃ������悤�Ɏv����D�܂��C�����̐f�ÉȂ�L����{�݂ł́C�ψ���̈ψ��ɂ����̈�ȊO�̈��i�� �R�c�������s���Ă���Ǝv����D�܂��̗p��i���̐����Ƃ������v�����e�����Ă���悤�Ɏv����D����ŁC�ߔN�}���ɕ��y���Ă��� EBM�̍l�����͎�������Ă���̂��낤���D�������C�ψ���łǂ̂悤�ȋc�_���Ȃ���C�ǂ̂悤�Ȋ�őI���E�̗p����Ă��邩�� �قƂ�ǖ��炩�ɂ���Ă��Ȃ��D�����ŁC����͍̗p���i�����ڂ��Ă���a�@���i�W(hospital formulary)�̖����ƍ쐬�̌���ɂ��Ă� �����𒆐S�Ƃ��āC���i�̐V�K�̗p�C�戵���~���ǂ̂悤�ȃv���Z�X�ōs���Ă���̂��𖾂炩�ɂ���ƂƂ��ɁC�������ɂ��čl�@�� �s�����D
�@1.�@���@�@
�@1)�@�ΏۂƂ�����Ë@��
�@����͗\���I�����Ƃ��āC��r�I���͂����₷���ƍl��������{��܉u�w���(�����419�l�C2000�N4������)�̏������Ă����Ë@�� 122�{�݂�ΏۂƂ����D����͑�w�a�@(���@���܂ށC���ȑ�a�@������)46�{�݁C��ʕa�@�E�f�Ï�76�{�݂ł���D
�@2)�@�A���P�[�g�Ώێ�
�@�A���P�[�g�̋L���҂͖�ܕ���(��ǐӔC��)��z�肵���D���R�͍̗p���i�̏��ɍł��ڂ����C�������̏ꍇ���i�̐V�K�̗p���邢�� ���~�����肷��ۂɐ[���֗^���Ă���ƍl�����邽�߂ł���D�A���P�[�g��2000�N5��9���ɔ����C���N6��6���Ƀt�H���[�A�b�v�C���N6��23���� 2�x�ڂ̃t�H���[�A�b�v���s�����D
�@2.�@��͕��@
�@�\�v�Z�v���O�����uExcel98�v���g�p���C�f�[�^�̐�������щ�͂��s�����D�A���ϐ��͕��ϒl�}SD�ŕ\���C���֊W�̉�͂ɂ͉�A���͂� �p�����D�s�A���ϐ����܂ރf�[�^�̉�͂ɂ̓�2��@��p���C�L�Ӑ�����0.05�Ƃ����D
�@3.�@���@��
�@1)�@���Ǝ{�݃v���t�B�[��
�@�{�ݐ���112�{�݂ŁC����91.8���ł������D���̂����L����99�{�݁C���L����13�{�݂ł������D�̂����� �{�݂̕a�@��ʂ̕a�����C��t���C��t���C�I�[�_�����O�������C�@�O�������s����Table 1�Ɏ����D

�@2)�@�a�@�K��(�a����)�ƍ̗p���i���Ƃ̊W
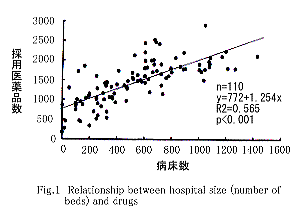 �@�a�@�K�͂̎w�W��a�����Ƃ��C�̗p���i���Ƃ̊W��Fig. 1�Ɏ���(n=110)�D��A��y��772�{1.254x�C��^��R2��0.565(p��0.001)�ƂȂ�C
���v�w�I�ɗL�ӂȑ��֊W��F�߂��D
�@�a�@�K�͂̎w�W��a�����Ƃ��C�̗p���i���Ƃ̊W��Fig. 1�Ɏ���(n=110)�D��A��y��772�{1.254x�C��^��R2��0.565(p��0.001)�ƂȂ�C
���v�w�I�ɗL�ӂȑ��֊W��F�߂��D�@3)�@���i�W�̍쐬�̌���
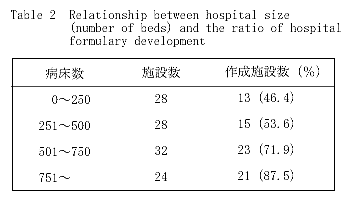
�@���i�W���쐬���Ă���{�݂�72(64.3��)�ł������D�����Łu���i�W�v�Ƃ́C�̗p���i�̖���(���W���C�K�i�ܗʁC�܌`���܂ށj�̂ق��� ���\�E���ʁC����p�Ȃǂ̈��i�������ڂ������q�Ƃ����D
�@�a�@�K��(�a����)�ɂ��w�ʂ����Ƃ���CTable 2�Ɏ����悤��250���ȉ��̎{��(n��28)�ł̍쐬�̊�����46.4���C251���ȏ�500���܂ł� �{��(n��28)�ł�53.6���C501���ȏ�750���܂ł̎{��(n��32)�ł�71.9���C751���ȏ�̎{��(n��24)�ł�87.5���ł���C�a�@�K�͂��傫���Ȃ� ���쐬�̊����͍����l���������D
�@���i�W�쐬���̏�ɂ��Ă̖₢�ł́C�Y�t�����Ƃ̉�68.1���C���{���i�W41.7���C�Y�t�����W26.4���C�s�̃f�[�^�x�[�X 18.1���C�����ȃz�[���y�[�W8.3���C���̑�18.1���C����4.2���ł�����(n��72�C������)�D
�@���i���ȊO�̎��ړ��e�Ƃ��ẮC���i�̎戵���Ɋւ���@���̋K��Ƃ̉�66.7���C��ܕ��Ɩ��̗��p�ē�30.6���C���ڕʂ� ���i�̈ꗗ�\56.9���C���̑�48.6���C����9.7���ł�����(n��72�C������)�D���̑��Ƃ��ẮC�����ИA����10�{�݁C���� 9�{�݁C�@������7�{�݁C�������^�̏��6�{�݂Ȃǂ̉��������D
 �@���i�W�쐬�̈Ӑ}�Ƃ��ẮC�戵���i�̊m�F�Ƃ̉�91.7���C���i�̓K���g�p�̂��߂̏��̊m�F��79.2���ł���C���i
���ȊO�̈��i�ɌW��@���K��̎��m��45.8���ł�����(n��72�C������)�D
�@���i�W�쐬�̈Ӑ}�Ƃ��ẮC�戵���i�̊m�F�Ƃ̉�91.7���C���i�̓K���g�p�̂��߂̏��̊m�F��79.2���ł���C���i
���ȊO�̈��i�ɌW��@���K��̎��m��45.8���ł�����(n��72�C������)�D�@���i�W���쐬���Ă��Ȃ��{�݂ɂ����邻�̗��R���L�q���Ŗ₤���Ƃ���(40�{�ݒ�31�{�݂���)�C�}���p���[�̕s���Ƃ̉�10�{�݁C �����I�[�_�����O�V�X�e���œY�t�������̎Q�Ƃ��\�ł��邽�߂�9�{�݁C��p�̖�肪8�{�݂Ə�ʂ��߂��ق��C�X�V�����A���^�C�� �ɂł��Ȃ��Ƃ̉�3�{�݂������D
�@���i�W�ɔ�ȕւɍ쐬���\�Ǝv����C�̗p���i�̖���(���W���C�K�i�ܗʁC�܌`���܂�)�݂̂����ڂ������q���u���i�ꗗ�v �Ƃ����D���i�ꗗ���쐬���Ă���{�݂�32(28.6��)�ł������D
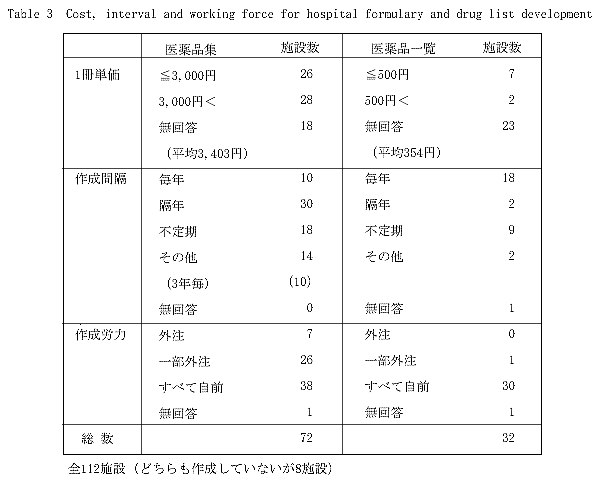
�@���i�W�̕��ύ쐬�P��(n��54)��3,401�}2,191�~�ł���C���i�ꗗ(n��9)�ł�354�}271�~�ł������D1���P���C�쐬�Ԋu�C�쐬�J�͂� ���Ĉ��i�W�ƈ��i�ꗗ�Ƃ��r�������ʂ�Table 3�Ɏ����D
�@4)�@���i�̗̍p�̌���
�@���i�̗̍p�̌���@�ւ�ψ���Ƃ���{�݂�98(87.5��)�ł������D���̑��Ƃ��Ĉ�lj�Ƃ̉�3�{�݁C�@���Ƃ̉�6�{�� ������(n��112)�D
�@�ψ���̊J�Õp�x�͔N3�`4��Ƃ̉�17�{�݁C�u����29�{�݁C������42�{�݁C�s�����6�{�݁C���̑���4�{�݂ł�����(n��98) �D�ψ����̉@���ł̖�E�́C�@��20.4���C���@��23.5���C��ܕ���20.4���C�@���C���@���ȊO�̈�t(�f�Õ����C������)33.7���C���� 2.0���ł�����(n��98)�D
�@�V�K�̗p�ɂ��Ċ�����邩�̖₢�ɁC�u�͂��v�Ƃ̉�81�{�݁C�u�������v�Ƃ̉�23�{��(����8�Cn��112)�ł������D�u�͂��v�� �����{�݂̂����������������Ă���Ƃ̉�57�{�݁C����������Ă��Ȃ��Ƃ̉�24�{��(n��81)�ł������D�܂��C�̗p�̊�� �uEBM�̍l������������Ă��܂����D�v�Ƃ̖₢�ɁC�u�͂��v�Ɖ����{�݂�35�C�u�������v�Ɖ����{�݂�25�C�u����������v�Ɖ��� �{�݂�18(����3�Cn��81)�������D
�@�V��̗̍p�ɂ��ē��ʂȔz�������Ă���Ɖ����{�݂�53�C���Ă��Ȃ��Ƃ����{�݂�51(����8�Cn��112)�ł������D�̗p�i�ڐ�����萔�� �����Ȃ��悤�[�u���u���Ă���Ɖ����{�݂�88�C���Ă��Ȃ��Ƃ����{�݂�21(����3�Cn��112)�ł������D
�@�ψ���̈ӎv����̍����ɂ��āu�ψ���̈ӎv����͉��Ɋ�Â������������������D(�@�`�C���I�����Ă��������D)(�����j �@�G�r�f���X�̗L���ɂ��@�A���i�̍���@�B���@�C���̑�(���R�L��)�v�Ƃ̐ݖ�ɂ��₤���Ƃ���C�@�G�r�f���X�̗L���ɂ��Ƃ̉� 56�{�݁C�A���i�̍���24�{�݁C�B��21�{�݁C�C���̑�46�{�݂ł�����(����8�Cn��98)�D�ψ���ł̍̌��̕��@�ł͑������Ƃ̉� ��41�{�݁C�����v49�{�݁C���̑�10�{�݂ł�����(�����C����1�Cn��98)�D
 �@�ψ���ō̗p����������ۂ̎����̍쐬�́C�̂�����104�{�݂��ׂĂŖ�ܕ����邢�͖�t���֗^���Ă����D��ܕ��Ǝ������Ƃ�
�쐬����Ƃ̉�3�{�݂������D�����ɂ��āu�����쐬����EBM���l���������̂ɂȂ��Ă��܂����D�v�Ɩ₤���Ƃ���C�u�͂��v�Ƃ̉�41
�{�݁C�u�������v57�{�݁C����14�{�݂ł�����(n��112)�D�����2�̃O���[�v�ɂ��Ă��̎����\�����r�����DFig. 2�̂悤�ɓY�t����
68.3���F66.7���C�C���^�r���[�t�H�[��63.4���F43.9���C���i�T�v70.7���F71.9���C�������r���[36.6���F22.8���C�����_��19.5���F12.3���ł���C
�C���^�r���[�t�H�[����19.5���C�������r���[��13.8���̍����F�߂�ꂽ�D
�@�ψ���ō̗p����������ۂ̎����̍쐬�́C�̂�����104�{�݂��ׂĂŖ�ܕ����邢�͖�t���֗^���Ă����D��ܕ��Ǝ������Ƃ�
�쐬����Ƃ̉�3�{�݂������D�����ɂ��āu�����쐬����EBM���l���������̂ɂȂ��Ă��܂����D�v�Ɩ₤���Ƃ���C�u�͂��v�Ƃ̉�41
�{�݁C�u�������v57�{�݁C����14�{�݂ł�����(n��112)�D�����2�̃O���[�v�ɂ��Ă��̎����\�����r�����DFig. 2�̂悤�ɓY�t����
68.3���F66.7���C�C���^�r���[�t�H�[��63.4���F43.9���C���i�T�v70.7���F71.9���C�������r���[36.6���F22.8���C�����_��19.5���F12.3���ł���C
�C���^�r���[�t�H�[����19.5���C�������r���[��13.8���̍����F�߂�ꂽ�D�@5)�@���i�̎戵�����~�̌���
�@���i�̎戵�����~�̌���@�ւ�ψ���Ƃ���{�݂�98(87.5��)�C���̑��̉�11�{�݂ł�����(����3�Cn��112)�D
�@�̗p���~�ɂ��Ċ������Ɖ����{�݂�71�C�Ȃ��Ƃ̉�37�{�݂ł�����(����4�Cn��112)�D�������������Ă���Ƃ����{�݂� 36�C����Ă��Ȃ��Ɖ����{�݂�35�ł�����(n��71)�D�܂��C�̗p���~�̊�ɁuEBM�̍l������������Ă��܂����D�v�Ƃ̖₢�ɁC�u�͂��v�� �����{�݂�23�C�u�������v�Ɖ����{�݂�28�C�u����������v�Ɖ����{�݂�16(����4�Cn��71)�������D
�@�̗p���~�ɂ��Ċ�������Ȃ��Ƃ����{�݂ɂ��āC�ǂ̂悤�Ɍ��߂Ă��邩�L�q���Ŗ₤���Ƃ���C������25�{�ݒ�22�{�݂� �u�g�p���тɂ��v�Ƃ̉��������D�܂��C�u�ꑝ�ꌸ�v�������ɂ��Ă���Ƃ̉�5�{�݂������D
�@6)�@�̗p���i�̌������ɂ���
�@�̗p���i�̌������ɂ��āC����I�ɍs���Ă���{�݂�54�C����I�ɂ͍s���Ă��Ȃ��{�݂�31�ł�����(����27�Cn��112)�D�܂��C�K�v���� �s���Ă���Ƃ̉�72�{�݁C�s���Ă��Ȃ��Ƃ̉�7�{�݂ł�����(����33�Cn��112)�D�������̕��@�ɂ��ċL�q���Ŗ₤���Ƃ��� 94�{�݂�����������D�������̑ΏۂƂ����܂��g�p��(�o�ɗʁC�w���ʁC�����p�x�Ȃ�)����ɑI�����Ă���Ƃ̉�61�{�݁C���� ������̐�����ɑI�����Ă���Ƃ̉�6�{�݂������D
�@7)�@�N���e�B�J���E�p�X�Ȃǂɂ���
�@�N���e�B�J���E�p�X(�N���j�J���E�p�X�C�P�A�E�}�b�v�C�P�A�E�p�X�Ȃ�)�̍쐬�ɂ��Ă̐ݖ�ł́C�쐬���Ă���Ƃ̉�44�{�݁C���Ă��Ȃ� ��63�{�݂ł�����(����5�Cn��112)�D�����̎����ɂ��č쐬���Ă��邩�̐ݖ�ł�33�{�݂�����������D1�`5�Ƃ̉�15�{�݁C 6�`10��4�{�݁C11�`15��9�{�݁C16�ȏオ5�{�݂ł���C�ő��46�����ł������D�����̂������i���܂ރp�X�̐���₤���Ƃ���28�{�݂��� ���������D���̌��ʁC0�Ƃ̉�5�{�݁C1�`5��13�{�݁C6�`10��3�{�݁C11�`15��6�{�݁C16�ȏオ1�{�݂ł���C�ő��46�����ł������D
�@4.�@�l�@�@
�@1)�@���i�W�쐬�Ɋւ���
�@���i�W��72(64.3��)�{�݂ō쐬����Ă���C�܂��C���i�ꗗ��32(28.6��)�{�݂ō쐬����Ă����D�ǂ�����쐬���Ă��Ȃ��{�݂�8�{�݂̂� �ł������D
�@���i�W�ƈ��i�ꗗ���r����ƁC��p�ɂ�����10�{�̈Ⴂ���F�߂�ꂽ�D�܂��C���i�W�N���s���Ă���{�݂�72�{�ݒ�10�{�݂� �����Ȃ����C���i�ꗗ��32�{�ݒ�18�{�݂����N�������Ă���D���i�W�쐬�̈Ӑ}�Ƃ���91.7���̎{�݂������悤�Ɂu��舵����i�� �m�F�v��ړI�Ƃ���̂ł���C���i�ꗗ�ŏ\���ł���Ƃ��l������D
�@���i�W�Ɏ��ڂ���Ă�����i���̃f�[�^�\�[�X�͂قړY�t�������ł������D�ߔN�C�Y�t�����̉����͕p�ɂł���C���i�W�Ƃ��� ���s�����ꍇ�ɂ͒Ǖ�ɂ��Ή�����ق��Ȃ��C�����I�ȑΉ��͔��ɍ���ł���D�I�[�_�����O�V�X�e���ɓ��ڂ������i���̃f�[�^ �\�[�X�Ƃ��Ĕėp����Ă���u���f�B�X�f�[�^�v�́C���c�@�l��Ï��V�X�e���J���Z���^�[�����[�J�[��蒼�ړY�t�����̒����� �d�q���������̂ł���C3�J�����C�N4��X�V����Ă���D����C�a�@���i�W�̕Ҏ[�ɂ������ẮC�ŐV�̈��i������邽�߂ɁC���q �̌`���ɂ�����炸�C�d�q�����ꂽ���̊��p���K�v�Ǝv����D
�@2)�@���i�̗̍p����v���Z�X
�@�V�K�̗p�̌����87.5���̎{�݂Ŗψ���s���Ă����D�ψ���̈ӎv���肪���Ɋ�Â�����₤���ݖ�ł́C�u�G�r�f���X�̗L���v�� �̉�56�{��(57.1���C������)�ł������̂ɑ��C�u���i�̍���v��24�{�݁C�܂��u���v�Ƃ̉�21�{�݂ɂ̂ڂ��Ă���D�ȑO�ɂ� ���͕a�@�̎����Ɋ�^����v���ł������D2000�N4���̖����ɂ����i�̓K���ȊǗ��ɗv���鐳���ȃR�X�g�����ς���Ɩ��� �قƂ�lj������ꂽ�ƍl�����镝�ɂȂ��Ă���D�{�A���P�[�g�͂��̖�P������ɂȂ��ꂽ���̂ł���D���������āC�S���̖����ȑO�̏� �ꕔ���f���ꂽ���ʂƍl������D����͕ی���Â̌����������̒��ł����Ɍo�ό����̂悢��܂�I���C�̗p���邩����ł���C ���̂��߂ɂ͈��o�ϊw�I���͂̎g�p�̕��y�������]�܂��D
�@�Ȃ��C����̃A���P�[�g�ł́u�G�r�f���X�̗L���v���邢�́uEBM���l���v�̉ɂ��Ă��̎�@�┻�f������₵�Ă��炸�ꕔ�ɉ� �����炢�Ȃǂ̃R�����g���������������D����C�������s���ۂɂ͉��P�������D
�@3)�@���i�̗̍p���~����v���Z�X
�@�̗p���~�̌����87.5���̎{�݂Ŗψ���s���Ă����D���~�i�ڂ̌���ɂ������Ă͎g�p���т����ߎ�ƂȂ��Ă�����Ԃ����炩�� �Ȃ����D�킪���ɂ����Ă�WHO�̒���G�b�Z���V�����h���b�O�̍l�����̕��y���x���悤�Ɋ������邪�C�P�Ɏg�p���т݂̂��w�W�ɍ̗p ���~�����߂Ă����ƁC���E�W�����猜�����ꂽ�i�����ƂȂ��Ă��܂��댯�����뜜�����D
�@�܂��C�̗p���~����̖��_�Ƃ��āC���S�����Ȃǂ���g���ׂ��łȂ��i�ڂ��o���Ƃ��̑Ή�������D�M�҂̏�������{�݂ł́C��ܕ� �����S�����Ȃǂ͑��₩�Ɉ�t�ɏ����C�T�d�Ȏg�p�𑣂��C���邢�͓K���g�p�̂��߂̏����ēx����Ȃǂ̓w�͂͂Ȃ���� ���邪�C�����Ƃ��Đ����Ђ��������~�C���邢�͔̔����~�����肵�C�s�ꂩ������g����[�u���Ƃ�Ȃ�����@���ł̗̍p�𒆎~���邱�Ƃ� �܂�ł���D�������C�����Ђ��������邢�͔̔����~�����肵���ꍇ�ɂ́C�o�ߑ[�u�̊������c���Ă��Ă��C���₩�ɍ̗p�𒆎~���C�\�� ������ɖ�܂̕ԕi�ɂ͉����Ă��������Ă���D����͂��̓_�ɂ��Đݖ�̐ݒ肪�s�\���ł������D�����̒����̍ۂɂ͐ݖ�ݒ���H�v �������ƍl����D
�@4)�@�ψ���̎����쐬�Ɋւ���
�@(1) �����쐬����EBM�̎~�ߕ��̑���
�@�����ɂ���EBM���l�����Ă���Ƃ���41�{��(41.8��)�ƁC�l�����Ă��Ȃ��Ƃ���57�{��(58.2��)�ŁC�����\�����r����Fig. 2�ł̓C���^�r���[ �t�H�[���̎g�p�̗���63.4����43.9����19.5���قȂ�ق��́C���҂ɑ傫�ȍ��͔F�߂��Ȃ������D�����Ɏg�p���Ă���䗦�̍������i�T�v�� �Y�t�����͂܂����������Ȃ������D���̂��Ƃ́C����̒S���҂�EBM�Ƃ����p��̎~�ߕ��C�����̒��x�ɍ������邱�Ƃ��������Ă���� �v����D
�@(2) �v������r���[�h �h�L�������g�̕K�v��
�@�O�q�̂悤�ɁC�����쐬����EBM���l�����Ă���Ƃ����41�{��(41.8��)�ɗ��܂��Ă���C�����̎��̌���̊ϓ_����C���I�@�ւ�w�� �Ȃǂ���̈��̎w�j�ɗނ�����̂̒��K�v�Ǝv��ꂽ�D����ɂ͊e�{�ݖ��Ɏ������쐬���Ă��錻��ɑ��āC�{���Ɏ{�ݖ��ɍ쐬���� ���Ƃ��K�v�ł���̂��Ƃ������^�₪�������DEBM�̍l�����܂�����������@�ւō쐬���C�e�{�݂ł͂��̏�����{���Ƃ��C�{�݂� ���������������I���W�i���̎������쐬���邩�C�ꍇ�ɂ���Ă͂��̂܂ܗ��p����Ƃ��������Ƃ͍l�����Ȃ����낤���D�\�ł���Εa�@ ��t�̘J�͂̑����Ȑߖ�ɂȂ�Ǝv����D
�@5.�@���@�_
�@���{�̕a�@���i�W����ш��i�̗̍p�E���~�̌���ɌW�錻�����x���炩�ɂȂ����D
(1) ���i�W��64.3���̎{�݂ō쐬����Ă���C���i�ꗗ��28.6���̎{�݂ō쐬����Ă����D
(2) ���i�W�ƈ��i�ꗗ���r����ƁC��p�ɂ�����10�{�̈Ⴂ���F�߂�ꂽ�D
(3) ���i�W�Ɏ��ڂ���Ă�����i���̃f�[�^�\�[�X�͂قړY�t�������ł������D
(4) �̗p�E���~�̌����87.5���̎{�݂Ŗψ���s���Ă����D
(5) �V�K�̗̍p�ɓ������ẮC�ꑝ�ꌸ�������Ƃ���ȂLj�萔���Ȃ��悤�^�p���Ă���{�݂����悻8���������D
(6) ���~�i�ڂ̌���ɂ������Ă͎g�p���т����ߎ�ƂȂ��Ă����D
(7) �ψ���̎����ɂ���EBM���l�����Ă���Ƃ���41�{�݂ƁC�l�����Ă��Ȃ��Ƃ���57�{�݂ŁC�����\�����r�����Ƃ���傫�ȍ��� �F�߂��Ȃ������D
�@�����̒m������̗p���i��K�ȃ��C���A�b�v�Ƃ��邽�߂ɂ͈ȉ��̂��Ƃ��]�܂��D
(1) ���i�̑I����g�p�ɍۂ��ēd�q�����ꂽ����L���ɗ��p����V�X�e�����\�z����ȂǁC���ӂ̊��̐����𑁋}�ɐi�߂邱�ƁD
(2) ��̑I���̊��K�ɒ�߂�K�v������C�P�Ȃ�i�ڐ��̐�����C�]���̊��K���邢�̓I�[�\���e�B�[�̈ӌ��ɂ��������̂ł͂Ȃ��C EBM�̎�@��蒅�����Ă������ƁD
(3) ���̌o�ς̎���͂قڏI���Ă���C��ẪR�X�g�x�l�t�B�b�g���l�������C�o�ό����̂悢��܂�I�����邽�߂̔w�i���Ȃ��w��Ƃ��Ă� ��܌o�ϊw�̈�w�̐i�W�D
�@����̒�����122�{�݂�ΏۂƂ����\���I�����ł���D���̒������ʂ���ՂƂ��āC������L�͈͂Ȏ{�݂�ΏۂƂ������������I�ɍs�� ���Ƃ��]�܂��D